MAST HÜCRESİ, BAZOFİL VE DERİNİN BAZOFİL AŞIRIDUYARLILIĞI |
|||||||||
MAST HÜCRESİ VE BAZOFİL1877 yılında Paul Ehrlich (97), histolojik teknikler için yeni sentetik anilin boyaları denerken, bazı konnektif doku hücreleri keşfetmiştir. Bu hücrelerin boyalara karşı büyük ilgi gösteren granüllerinin bulunduğunu ve bu granüllerin boyanın tonunu değiştirme eğilimlerinin bulunduğunu görmüştür. İyi beslenmiş kimselerin konnektif dokularında bu hücrelerin daha fazla olması nedeni ile, bu hücrelere, "İyi beslenmiş hücre" anlamına gelen "Mastzellen" adını vermiştir. Genç embryoda mast hücresi yoktur. Bu hücreler, embryonik hayatın sonuna doğru görülmeye başlarlar (39,98). Zamanla da bazı bazik boyalarla metakromatik olarak boyanan sitoplazmik granüllerini geliştirirler (39). Kemik iliğinden kaynaklanan bazofil, nötrofil, eozinofil, histiyosit, lenfosit gibi hücrelerden farklı olarak, mast hücrelerinin, farklılaşmamış mezankimal hücrelerden kaynaklandığı kabul edilmektedir (37, 99-101). Mast hücreleri konnektif dokunun normal elemanları olup, vücutta yaygın bir biçimde dağılmışlardır (37, 102). Akciğerde bronşiyal lümende serbest olarak, bronşiyal ve gastrointestinal mukozada intraepitelyal ve derinde perivenüler olarak (38), myokardın interstisyumunda, yağ hücreleri arasında, peritonda, çoğu organın kapsülünde (98), meme glandlarında (101) bulunurlar. İnsan dokularında 1-10 x 106 hücre/gram konsantrasyonda bulundukları bildirilmiştir. Derideki mast hücreleri, dermoepidermal fonksiyonda ve perivenüler olarak yerleşen (38) serbest hücreler halindedirler (103). Bölgelere göre büyük değişiklik göstermekle birlikte (104), derinin milimetreküpünde ortalama 7000-12000 mast hücresi bulunmaktadır (100). Skrotum derisinde, bacaktakinden dört misli fazla mast hücresi vardır (104). Tonsil/adenoid, nazal polip dokularında da çok bulunurlar (105). İyileşen yaralarda, kronik enflamasyonlarda, parazitik enfestasyonlarda (42, 102, 106), neoplazilerde (102, 107) ve ürtikarya pigmentozada mast hücresi hiperplazisi görülür (42, 102, 106). Sık olarak travmaya maruz kalan dokular, bu hücrelerden özellikle zengindirler (98).
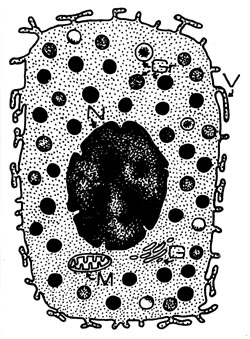
Ovoid veya uzun, çok yüzeyli, dik kenarlı olabilen mast hücrelerinin (101, 107, 108) boyları 8-15 mikron arasında değişir ve ortalarında koyu boyanmış bir nukleusları vardır. Büyük ve oval olan nukleus, bazofillerden farklı olarak tek lobludur (37, 42, 99, 102). Sitoplazma hacminin çoğunu, bazik tiyonin boyalarıyla boyandığında karakteristik olarak metakromatik bir görünüm alan granüller oluşturlar (Şekil 1). Hematoksilen ve eozinle boyanan kesitlerde granüller görülmeyebilir. Bu yüzden mast hücreleri, histiyositlerden ve konnektif dokunun diğer mononükleer elemanlarından ayırt edilemez (99). Granüller, toluidin mavisi veya metilen mavisi gibi bazik boyalarla metakromatik olarak mor renkte boyanırlar. Metakromazi, bazı doku maddelerinin selektif olarak boyanın renginden farklı boyanmasıdır (37). Bu hücrelerdeki metakromazi, sülfatlı bir asit mukopolisakkarid olan heparin içermelerine dayanmaktadır (37,102). Naftol-ASD-klorasetat esteraz yöntemi ile boyanırsa, mast hücrelerinin hem şekli, hem de granülleri kolayca ayırt edilebilir hale gelir (109) (Şekil 2).
Mast hücrelerinin granülleri 0.6-0.7 mikron boyunda (37) olup, bir membranla çevrelenmişlerdir (101). Bu granüller, fonksiyonel anlamı bilinmeyen bazı subgranüler yapılara sahiptir (38), lamellar halkalar biçiminde (37) parakristalin yapılar gözlenir (99). Granüller öyle çoktur ki, metakromazi oluşturan boyalarla boyanmış kesitlerde nukleusun çoğu kez örtüldüğü görülür (109). Mast hücresinin membranı, parmak şeklinde, plazma membranının (107) villöz çıkıntılarıyla (37,98) buruşuk bir görünümde olup, IgE'nin Pc kısmı, C3a ve C5a için sınırlı reseptörler olarak 50-300.000 reseptöre sahiptir (38). Mast hücrelerinde endoplazmik retikulum seyrek olup (37,99), mitokondriler azdır. Golgi kompleksi ise iyi gelişmiştir (37). Spesifik immun reseptörlü mast hücreleri, güçlü toksik ya da zararlı ajanın giriş kapılarına yerleşmişlerdir. Zararlı eksojen materyalin giriş yerinde mast hücrelerinin bulunuşu, bu hücreyi mobilizasyon ve lokalizasyon gereksiniminden kurtarır (38). Bir anlamda mast hücreleri, dokuda oturan tek faal hücre olmaları nedeniyle hücresel immun savunmanın ilk hattıdırlar. Diğer hücrelerin tümü, dokuya kan yoluyla gelirler (37). 1891 yılında Ehrlich (110), bazofil lökositi, daha önce tanımlamış olduğu mast hücresinden farklı, bir polimorfonükleer formu olarak tanımlamıştır. Mast hücreleri ve bazofiller, morfolojileri ve vazoaktif amin içerikleri bakımından birbirlerine çok benzemekle birlikte, bazı özellikleri açılarından da farklılıklar gösterirler. Mast hücrelerinin büyük bir oval nukleusu vardır; oysa bazofiller granülositlerin tipik çok loblu nukleusunu taşırlar. Mast hücrelerinin bazofillere oranla daha küçük ve daha çok sayıda granülleri vardır (37, 42, 99, 102). Bazofillerin granüllerinde, mast hücrelerinin granüllerinde rastlanan parakristalin yapılar yoktur. Her iki tip hücrenin de IgE reseptörleri vardır ve her ikisi de hücre yüzeyi IgE'si ile spesifik antijenler birleştiğinde degranüle olurlar (99). Mast hücrelerinin granüllerinin salınmasının analizinde temel olarak, histaminin kimyasal olarak ölçülmesi, ya da mast hücrelerinin degranülasyonunu gösteren sitolojik çalışmalardan yararlanılmıştır. Hem immünolojik, hem de nonimmünolojik faktörler boşalmaya neden olabilirler. İmmünolojik olmayan uyaranlar arasında kimyasal liberatörler (Compound 48/80 gibi amin ve amidin türevleri), çeşitli ilaçlar (morfin, kodein, polimiksin, kinin, tiyamin), bakteriyel toksinler, yılan zehirleri, biyolojik polimerler (deniz anası ve ıstakoz gibi) ve sıcak suya maruz kalma veya vurma gibi doğrudan fizik etkenler sayılabilir. Mast hücrelerinin plazma membranları üzerinde kolinerjik reseptörlerin de bulunduğu gösterilmiştir. Bu açıdan, asetilkolin ya da asetilkolin salınmasını sağlayan aktivitelerin de mast hücresi degranülasyonuna yol açtığı gösterilmiştir (99). Mast hücrelerinin degranülasyonundaki immünolojik mekanizmaların çoğu IgE'ye bağlıdır (37, 99, 105, 111). IgE, plazma hücreleri ve B lenfositler (100) tarafından yapılır ve bunun mast hücreleri ile bazofillere bağlanması tek tiptedir. İnsan IgE'sinin insan mast hücresine bağlanması için immunglobulinin Pc parçasına gereksinme vardır (37,99,105). Hücre yüzeyine bağlı bulunan iki tane IgE molekülüyle köprü oluşturan polivalan antijenler tarafından tetiklenen Tip I reaksiyonuyla degranülasyon başlar (37, 38, 99, 105). Hücre membranına bu şekilde sinyalin gelmesiyle membran aktive olur ve kalsiyum iyonları içeri akarlar, serin esteraz ortaya çıkar, enerjiye gereksinme olan bir fazdan sonra kalsiyuma bağlı ikinci bir olay olur ve hücre içinde siklik adenozin monofosfat çöker. Bu kompleks reaksiyonlar dizisi sonunda perigranüler membranlar hücre kenarına doğru hareket eder, plazma membranıyla kaynaşırlar. Daha sonra plazma membranında bir delik oluşur ve granül içi, hücre dışına çıkar (38, 99, 105) (Şekil 3).
Mast hücreleri ve bazofillerde iki çeşit mediator bulunur: I. Önceden yapılmış ve depolanmış mediatörler: Histamin, anafilaksinin eozinofil kemotaktik faktörü, eozinofil kemotaktik faktör oligopeptidler, nötrofil kemotaktik faktör, heparin, kondroitin 4 ve 6 sülfat, dermatan sülfat, kimaz, aril sülfataz, N-asetil- beta-D-glukozaminidaz, bazofil anafilaksisinin kallikreini, beta glukronidaz gibi. II. Yeni yapılan ve hemen ortaya çıkan mediatörler: Anafilaksinin yavaş tepki gösteren maddesi, trombosit aktive edici faktörler, lipid kemotaktik faktörler gibi (37,38). Heparin, granüllere metakromazi özelliğini veren madde olup, mast hücrelerinde sentez edilir ve proteine bağlıdır. İnsan heparini, molekül ağırlığı yaklaşık 60.000 olan bir proteoglikandır (37, 38). İnsan heparini, antikoagülasyonu hızlandırmak için insan antitrombin III'ü ile karşılıklı olarak birbirlerini etkilerler (38). Mast hücrelerinde heparin bulunan dokuların ekstreleri antikoagülan etki gösterebilmektedir. Bununla birlikte mast hücrelerinin deride biriktiği patolojik tablolarda kanın lokal koagülasyonu önlenememektedir. Bunun nedeni bilinmemekle (37) birlikte, olay, molekül ağırlığı ile açıklanmaktadır. Düşük molekül ağırlıklı heparin kuvvetli bir antikoagülan iken, mast hücrelerinden salınan yüksek molekül ağırlıklı heparinin antikoagülan aktivitesi çok azdır. Ayrıca, yüksek molekül ağırlıklı heparin, hücrelerden kan damarlarına kolaylıkla geçememektedir (102). Ağırlık olarak mast hücresi granülünün %30'unu oluşturan heparin (37), kompleman aktivasyonunun inhibisyonu gibi bir fonksiyona da sahiptir(38). Histamin de heparin gibi mast hücrelerinin granüllerinde depolanmaktadır (93). Riley ve West (39), her cinste derinin çeşitli tabakalarındaki mast hücresi yoğunluğu ile histamin düzeyleri arasında belirgin bir paralelliğin bulunduğunu göstermişlerdir. Histamin, enflamatuar reaksiyonların güçlü bir mediatörüdür. Düz kaslar üzerine hem doğrudan, hem de refleks etkiyle, kasılmalarını hızlandırır ve venüllerin endotelyal hücreleri arasındaki aralıklar genişler (38). Bu şekilde postkapiller venüllerin permeabilitesi artar (37,112); serum ve iltihap hücreleri dışarı çıkarlar (37). Granüllerde histamin, heparine bağlı olarak bulunur. Fizyolojik koşullar altında in vitro olarak heparin ve histamin arasındaki kompleks formasyonu zayıftır. Ancak, çinko iyonlarının varlığında belirgin bir biçimde artar. Bu bulgular, granül içinde heparin ve histamin arasında çok gevşek bir bağ bulunduğunu ve heparin-çinko-histamin kompleksi halinde stabilize olduğunu göstermektedir. Mast hücrelerinde lokal harabiyete yol açan maddeler, o bölgede tam bir histamin boşalmasına yol açmakta, bu bölgeye daha sonra yapılan herhangi bir kimyasal liberatör uygulaması sonuçsuz kalmaktadır. Harabiyetin derecesine göre mast hücreleri, yırtılmış ya da ölmüşlerdir, veya tekrar düzelirler. Yeni bir mast hücresi popülasyonunun tam olarak kurulması haftalar alır (98). Diğer mediatörler, konumuzun kapsamına girmediği için, burada onlardan söz edilmeyecektir. DERİNİN BAZOFİL AŞIRIDUYARLILIĞIDerinin bazofil aşırıduyarlılığı reaksiyonu, hücresel bir immunite biçimi olup (36), başlıca kobaylarda gözlenen, lenfosite bağlı geç başlangıçlı bir grup immünolojik reaksiyonun adıdır (106). Klasik tüberkülin tipi geç aşırıduyarlılıktan, mikobakteriyel adjuvanlar kullanılmaksızın, çeşitli antijenlerle oluşturulabilmesiyle ayrılır (36). "Jones-Mote reaktivitesi" adı da verilen bu durum, eriyebilir protein antijenlere karşı bir yanıt biçiminde tanımlanmıştır. Kobaylarda derinin bazofil aşırıduyarlılığı; kontakt allerjenler, vaksinya virüsü, tümör hücreleri, şistozomlar, böcek ısırmaları ve deri allogrefleri gibi çeşitli antijenlere karşı primer olarak çıkar. Hem geç aşırı duyarlılık, hem de derinin bazofil aşırıduyarlılığının ortaya çıkması için, immunojenik gereksinmeler vardır ve her ikisi de histokompatibiliteye bağlı immun yanıt genlerinin kontrolü altındadır. Her iki reaksiyonu da ortaya çıkarmak için gerekli olan deri testi antijenleri benzerdir ve bu antijenler, önceden var olan bir antikorla pasif bir kombinasyondan çok, mononükleer bir hücre yanıtının oluşması için gereklidirler. Dolanan antikorların ortaya çıkışı ile, Jones-Mote reaktivitesinin azalması arasında yakın bir karşılıklı ilişki vardır. Histopatolojik olarak kobaylardaki derinin bazofil aşırıduyarlılığı reaksiyonları; süreleri, gelişmeleri ve derideki dağılımları açısından geç aşırıduyarlılığa benzerler. Testten saatler sonra, perivasküler bir lenfosit birikimi olur. Tüberkülin tipindeki geç aşırıduyarlılığın aksine (106), değişik spesifik kemotaktik faktörler vasıtasıyla bazofiller enflamatuar alana çekilirler (36), zamanla da mutlak ve nisbi sıklıkta dramatik bir artış göstererek 24-48 saatte (106) hücresel infiltratın üçte biri ile yarısı arasında maksimum bir düzeye erişirler (42). Kobaylardaki araştırmalarda bazofillerin özellikle papiller dermiste lokalize oldukları gözlenmiştir. Eozinofiller, derinin bazofil aşırıduyarlılığı reaksiyonlarında değişken oranlarda bulunurlar, önde gelen hücre değillerdir. 48 saatte reaksiyon büyük ölçüde geriler, ancak hücresel infiltrat, bir haftanın üzerinde bir sürede yavaş olarak kaybolur. Geç aşırıduyarlılıktaki endürasyon, çoğu kez enflamatuar hücre birikimine bağlanmıştır. Ancak bu açıklama, derinin bazofil aşırıduyarlılığının endürasyonunu açıklamada yeterli olamamaktadır. Dvorak (106), damar geçirgenliğinin artmasına kısmen bağlı olan fibrin birikiminin de endürasyondan sorumlu olduğunu düşünmektedir. İnsanlarda kontakt bir allerjene karşı oluşturulan derinin bazofil aşırıduyarlılığı reaksiyonundan yapılan seri biyopsilerde, başlangıçta lenfositlerden oluşan perivasküler infiltratın, bazofiller tarafından izlendiği, ve bunların da sonradan eozinofillerle yer değiştirdiği gözlenmiştir. Hücresel infiltratın, dermal dokularda ödem ve fibrin birikimi gösteren vasküler permeabilite değişiklikleriyle birlikte olduğu görülür (42). Çeşitli cinslerde, bazofillerle mast hücrelerinin sıklığı arasında ters bir ilişki vardır (42,106). Örneğin sıçan ve farelerde, dolaşımda eser derecede az bazofile rastlanırken, deri gibi organlarda çok sayıda mast hücresi bulunur. Bu bakımdan bazofil ve mast hücrelerinin, benzer fonksiyonları bulunan bütünleyici hücreler oldukları, cinslere ve belki de antijenik davet yerine bağlı olarak, ikisinden birinin, ya da her ikisinin de hücresel aşırıduyarlılığa katkısı olabileceği düşünülebilir. Kobaylarda ve sıçanlardaki geç aşırıduyarlılık reaksiyonlarında histamin konsantrasyonunun artması şeklindeki eski bilgiler, dokuda fikse mast hücrlerinin aktivitesinde ve/veya sayısında artmayı düşündürecektir. Bu genel hipotezi destekleyen kanıtlar, insanlardan da elde edilmiştir. Geç tipteki reaksiyonlarda, özellikle papiller dermişin ödematöz zonu içinde ve yüzeyel mikrovaskülatür çevresinde kısmi mast hücresi degranülasyonu gözlenmiştir. Ayrıca insanlarda renal allogrefin atılma işlemi sırasında, greflemeden kısa bir süre sonra, mast hücresi hiperplazisi görülür (106). Bütün bu örneklerden sonra, derinin bazofil aşırıduyarlılığının, klasik geç aşırıduyarlılığa benzer bir biçimde, timus kökenli lenfositlere bağlı olduğu düşünülebilir (42). T lenfositler; bazofillerin gelişi, farklılaşması ve/veya mast hücrelerinin karşı yanıtı, bu hücrelerin degranülasyonu ve diğer fonksiyonlarından sorumlu olabilirler (106). Derinin bazofil aşırıduyarlılığı, duyarlanmış bir hayvandan, duyarlanmamış bir hayvana lenf nodülü hücreleri ile aktarılabilmekte, serumla aktarılamamaktadır. Bu tür aşırıduyarlılık, antilenfosit serumla muameleden sonra da inhibe edilebilmektedir. Derinin bazofil aşırıduyarlılığında, bazofillerin rolü açık olmamakla birlikte, rollerinin fagositik bir fonksiyondan çok, heparin ve vazoaktif aminleri içermeleriyle ilgili olduğu sanılmaktadır (42). |
|||||||||
| Araçlar ve Yöntemler |